-
iPSC 定向分化類器官:重塑疾病研究與治療的前沿格局
2025/12/9 10:43:37 來源:財訊網 【字體:大 中 小】【收藏本頁】【打印】【關閉】
核心提示:在再生醫學與疾病研究的浪潮中,誘導多能干細胞(iPSC)技術正以顛覆性力量改寫行業規則。在再生醫學與疾病研究的浪潮中,誘導多能干細胞(iPSC)技術正以顛覆性力量改寫行業規則。其核心魔力在于將成熟體細胞重新編程為具備全能分化潛能的多能干細胞,通過精準誘導分化,可定向培育出形態與功能高度模擬人體真實器官的微型三維組織模型——類器官。從糖尿病到帕金森病,從肝臟疾病到心血管疾病,這些 “迷你器官” 正突破傳統研究瓶頸,為疾病機制解析、個性化治療方案開發提供全新工具,成為生物醫學領域的璀璨新星。
↑ 誘導多能干細胞(iPSC)的形態
一、hiPSC源胰島類器官:糖尿病治療的革命性突破
糖尿病是一種全球性高發的慢性代謝性疾病,其核心問題是胰島β細胞功能受損,導致胰島素分泌不足。hiPSC源胰島類器官的出現為糖尿病研究和治療帶來了新的希望。通過特定的生長因子和信號分子,hiPSC能夠被誘導分化為胰島β細胞,并進一步構建為胰島類器官。
這些類器官不僅在形態上高度模擬真實胰島,還能在體外響應血糖變化,自動調節胰島素分泌,從而維持血糖穩定。在動物模型中,hiPSC源胰島類器官已經展現出顯著的血糖調節能力,為未來的細胞替代療法提供了有力支持。此外,結合基因編輯技術,科學家們能夠在體糾正導致糖尿病的基因突變,實現個性化的β細胞再生。這種從根源上解決問題的方法,有望徹底改變糖尿病的治療格局。
盛合瑞生物的iPSC類器官分化平臺為hiPSC源胰島類器官的培養提供強力支撐,配合分步誘導方案,通過葡萄糖刺激實驗明確了hiPSC源胰島類器官的胰島素分泌功能。此外,單細胞測序結果明確了盛合瑞生物構建的hiPSC源胰島類器官的細胞組成。通過免疫熒光染色檢測β細胞與α細胞分布等多維度驗證,確保hiPSC源胰島類器官的功能完整性。結合類器官基因編輯技術,移植后有望在體內糾正糖尿病相關基因突變,實現個性化β細胞再生,為糖尿病患者帶來治愈的希望。
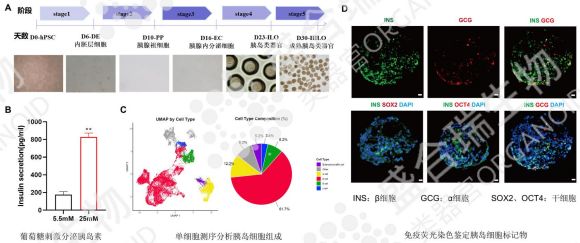
↑ 盛合瑞生物構建的hiPSC源胰島類器官
二、hiPSC源肝類器官:肝臟疾病研究的全能工具
肝臟是人體內最重要的代謝器官之一,負責解毒、合成蛋白質和調節代謝等多種功能。hiPSC源肝類器官的出現為肝臟疾病的研究和治療提供了新的工具。通過精確的誘導分化,hiPSC能夠被分化為肝細胞,并構建為具有功能的肝類器官。這些類器官能夠高度模擬肝臟的微環境,展現出與真實肝臟相似的代謝功能。
在疾病模型構建方面,hiPSC源肝類器官能夠用于模擬多種肝臟疾病,如肝炎、肝硬化和肝癌。通過高通量藥物篩選,這些類器官能夠快速評估新藥的療效和安全性,為肝臟疾病的治療提供新的思路。此外,hiPSC源肝類器官還能夠用于患者特異性的細胞替代療法,避免免疫排斥反應。這種個性化治療方案不僅提高了治療的安全性和有效性,還為肝臟再生醫學提供了新的方向。
盛合瑞生物已成功構建hiPSC源肝類器官,通過HE及免疫熒光染色鑒定了肝類器官的細胞組成,結合培養上清中白蛋白、α1-抗胰蛋白酶、膽汁酸分泌水平及細胞色素P450 3A4活性檢測,全面確保盛合瑞生物構建的hiPSC源肝類器官的成熟度與功能完整性。該類器官模型可廣泛應用于肝炎、肝硬化、肝癌等疾病模型構建,通過高通量藥物篩選快速評估新藥療效與安全性,同時為患者特異性細胞替代療法提供可能,有效避免免疫排斥反應,為肝臟再生醫學開辟全新路徑。

↑ 盛合瑞生物構建的hiPSC源肝臟類器官
三、hiPSC源中腦類器官:帕金森病的治愈新曙光
帕金森病作為常見神經退行性疾病,以大腦多巴胺神經元持續退化為主要特征,傳統治療難以逆轉神經損傷。hiPSC源中腦類器官通過特定誘導條件,使hiPSC分化為中腦多巴胺能神經元并構建成功能完整的類器官,不僅形態模擬真實中腦,更具備良好的神經信號傳導能力。
盛合瑞生物通過免疫熒光染色鑒定了hiPSC源中腦類器官中多巴胺能神經元的分化情況及多巴胺分泌水平,確保中腦類器官的功能達標。在動物實驗中,移植盛合瑞生物hiPSC源中腦類器官的小鼠已展現出顯著行為改善,肢體僵硬癥狀緩解、顫抖頻率大幅降低,充分驗證了其治療潛力。結合類器官基因編輯技術糾正致病基因突變,可能實現個性化神經元再生,有望從根源上破解帕金森病治療難題,為臨床應用奠定堅實基礎。
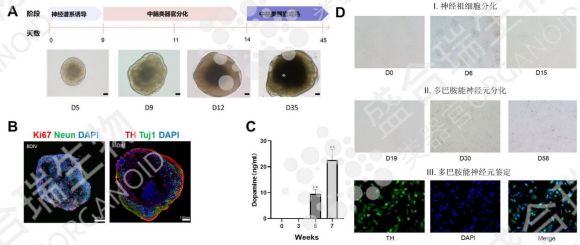
↑ 盛合瑞生物構建的hiPSC中腦類器官
四、hiPSC源脊髓類器官:脊髓損傷修復的新航道
脊髓損傷常導致不可逆的運動與感覺功能障礙,治療難度極大。hiPSC源脊髓類器官通過精準誘導分化,形成包含脊髓神經元與支持細胞的三維模型,形態與真實脊髓高度相似,且具備良好的神經信號傳導能力。
盛合瑞生物采用分步誘導方案構建了hiPSC源脊髓類器官,通過免疫熒光染色明確了hiPSC源脊髓類器官中脊髓神經元分化情況。在動物模型中,移植該類器官的小鼠已實現顯著運動功能恢復,證實了其脊髓損傷修復潛力。該模型為脊髓損傷的機制研究、藥物研發及細胞替代療法提供了全新工具,有望改寫脊髓損傷治療的現狀。
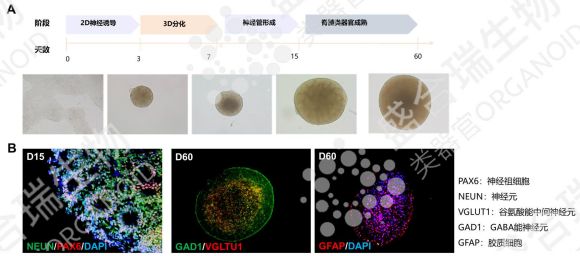
↑ 盛合瑞生物構建的hiPSC源脊髓類器官
五、hiPSC源內耳類器官:聽力損失的重建希望
聽力損失作為高發感官障礙,嚴重影響患者生活質量,而hiPSC源內耳類器官的出現為其治療帶來新方向。通過特定誘導條件,hiPSC可分化為內耳毛細胞與支持細胞,內耳類器官不僅形態模擬真實內耳,更具備良好的聽覺信號傳導能力。動物實驗中,移植該類器官的小鼠已實現顯著聽力恢復,為臨床應用提供了有力佐證。
盛合瑞生物通過分步誘導方案構建了hiPSC源內耳類器官,并采用免疫熒光染色鑒定出耳囊階段祖細胞、毛細胞、聽覺神經元等各類細胞組成。未來進一步結合類器官基因編輯技術糾正致病基因突變,可能實現個性化耳蝸毛細胞再生,有望徹底改變聽力損失的治療格局。
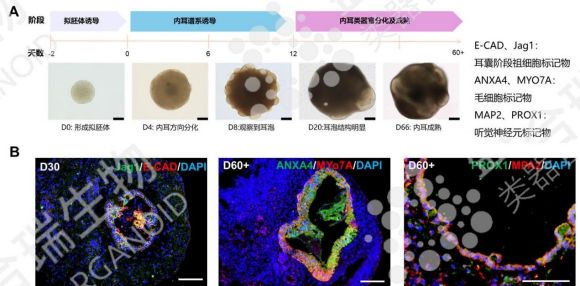
↑ 盛合瑞生物構建的hiPSC源內耳類器官
六、hiPSC源心臟類器官:心血管疾病研究的核心平臺
心血管疾病作為全球主要死亡原因,其研究與治療一直面臨模型局限。hiPSC源心臟類器官通過誘導分化形成心肌細胞、成纖維細胞與心外膜細胞,構建的三維模型不僅形態模擬真實心臟,更能展現出完整的收縮與舒張功能。
該類器官可高效模擬心肌梗死、心肌病、先天性心臟病等多種疾病模型,通過高通量藥物篩選快速評估新藥療效與安全性。
盛合瑞生物成功培養了hiPSC源心臟類器官,通過觀察自主搏動現象及免疫熒光染色鑒定細胞組成,確保hiPSC源心臟類器官的功能穩定。hiPSC源心臟類器官有望為心血管疾病的個性化治療與再生醫學研究提供核心支撐。
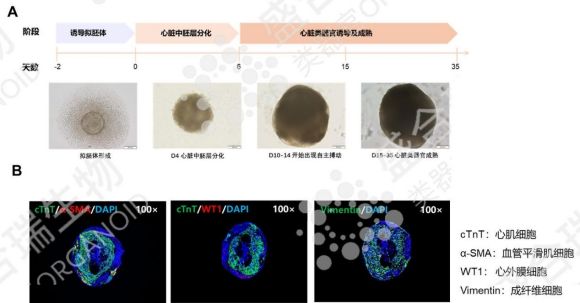
↑ 盛合瑞生物構建的hiPSC源心臟類器官
七、hiPSC源血管類器官:血管疾病研究的精準模型
血管疾病涉及血管狹窄、動脈粥樣硬化、血栓形成等復雜病理過程,傳統模型難以精準復刻。hiPSC源血管類器官通過誘導分化形成血管內皮細胞與平滑肌細胞,構建的三維模型形態與真實血管高度一致,且具備良好的收縮與舒張功能。
該類器官可有效模擬動脈粥樣硬化、血栓形成等疾病場景,為高通量藥物篩選提供精準平臺。此外,hiPSC源血管類器官還能夠用于患者特異性的細胞替代療法,避免免疫排斥反應。這種個性化治療方案不僅提高了治療的安全性和有效性,還為血管再生醫學提供了新的方向。
盛合瑞生物通過分步誘導方案構建hiPSC源血管類器官,免疫熒光染色明確了hiPSC源血管類器官的多種細胞組成,包括血管內皮細胞、血管平滑肌細胞以及基底層。在電鏡下能夠觀察到血管的微結構,如緊密連接,確保了模型的真實性與可靠性。該類器官為血管疾病的治療提供了全新思路與工具。
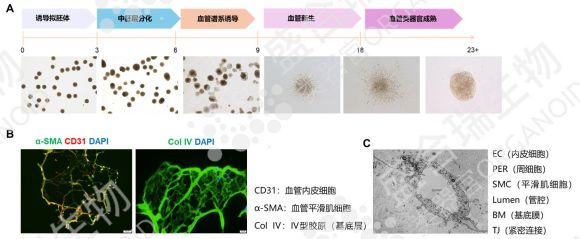
↑ 盛合瑞生物構建的hiPSC源血管類器官
總結:以技術創新賦能醫學未來
iPSC定向分化類器官技術的崛起,正重構疾病研究與治療的底層邏輯。從疾病模型構建到個性化細胞治療,從新藥篩選到臨床轉化,這些“迷你器官”已成為再生醫學領域的核心力量。從糖尿病到帕金森病,從肝臟疾病到心血管疾病,這些類器官不僅能夠用于疾病模型的構建,還能作為細胞替代療法的候選方案。隨著技術的不斷創新和臨床應用的推進,iPSC源類器官有望成為未來再生醫學的主流方案之一。
盛合瑞生物作為專注于類器官研發與服務的高新技術企業,憑借全面的產品體系和成熟技術平臺,為科研院所提供iPSC源類器官模型構建及相關產品,助力新藥研發企業進行藥物篩選與評價。公司以iPSC重編程、類器官培養、類器官基因編輯等核心技術為支撐,努力拓展類器官的應用邊界。未來,盛合瑞生物將繼續以創新驅動發展,推動iPSC技術走向臨床應用,為患者帶來治愈希望。
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播更多信息之目的,如有侵權行為,請第一時間聯系我們修改或刪除,多謝。